Nobel per la Medicina 2023 ai ricercatori Karikó e Weissman per i loro studi sui vaccini mRNA
Il Premio Nobel 2023 per la medicina è stato oggi assegnato congiuntamente a Katalin Karikó, ricercatrice di origine ungherese, ma attiva negli USA e allo statunitense Drew Weissman per le loro scoperte sulle modifiche delle basi nucleosidiche che hanno permesso lo sviluppo di vaccini efficaci a base di mRNA contro il COVID-19.
 Katalin Karikó |
 Drew Weissman |
Le scoperte dei due premi Nobel sono state fondamentali per sviluppare vaccini a mRNA efficaci contro il COVID-19 durante la pandemia iniziata nel 2020. Grazie alle loro scoperte rivoluzionarie, che hanno cambiato radicalmente la nostra comprensione del modo in cui l’mRNA interagisce con il nostro sistema immunitario, i premiati hanno contribuito al tasso di sviluppo di vaccini senza precedenti durante una delle più grandi minacce alla salute umana nei tempi moderni.
I vaccini prima della pandemia
La vaccinazione stimola la formazione di una risposta immunitaria nei confronti di un particolare agente patogeno. Questo dà all’organismo un vantaggio nella lotta contro la malattia nel caso di un’esposizione successiva. I vaccini basati su virus uccisi o indeboliti sono disponibili da molto tempo, come ad esempio quelli contro la poliomielite, il morbillo e la febbre gialla. Nel 1951, Max Theiler ha per esempio ricevuto il premio Premio Nobel per la Medicina per aver sviluppato il vaccino contro la febbre gialla.
Grazie ai progressi della biologia molecolare degli ultimi decenni, sono stati sviluppati vaccini basati su singoli componenti virali, piuttosto che su virus interi.
Parti del codice genetico, che di solito codificano proteine presenti sulla superficie del virus, sono utilizzate per produrre proteine che stimolano la formazione di anticorpi che bloccano il virus. Ne sono un esempio i vaccini contro il virus dell’epatite B e il papillomavirus umano. In alternativa, parti del codice genetico virale possono essere trasferite in un virus portatore innocuo, un “vettore”. Questo metodo è ad esempio utilizzato nei vaccini contro il virus Ebola. Quando si iniettano i vaccini vettoriali, la proteina virale selezionata viene prodotta nelle nostre cellule, stimolando una risposta immunitaria contro il virus bersaglio.
La produzione di vaccini a base di virus interi, proteine e vettori richiede una coltura cellulare su larga scala. Questo processo ad alta intensità di risorse limita le possibilità di una rapida produzione di vaccini in risposta a epidemie e pandemie. Per questo motivo, i ricercatori hanno cercato a lungo di di sviluppare tecnologie vaccinali indipendenti dalla coltura cellulare, ma ciò si è rivelato un’impresa ardua.
Vaccini a mRNA: Un’idea promettente
Nelle nostre cellule, le informazioni genetiche codificate nel DNA vengono trasferite all’RNA messaggero (mRNA), che viene utilizzato come modello per la produzione di proteine. Negli anni ’80 sono stati introdotti metodi efficienti per produrre mRNA senza coltura cellulare, chiamati trascrizione in vitro. Questo passo decisivo ha accelerato lo sviluppo di applicazioni di biologia molecolare in diversi campi. Anche l’idea di utilizzare le tecnologie dell’mRNA a scopo vaccinale e terapeutico ha preso piede, ma ben presto si sono presentati degli ostacoli. L’mRNA trascritto in vitro era considerato instabile e difficile da veicolare, richiedendo lo sviluppo di sofisticati sistemi di trasporto lipidico per incapsulare l’mRNA. Inoltre, l’mRNA prodotto in vitro dava luogo a reazioni infiammatorie. L’entusiasmo per lo sviluppo della tecnologia dell’mRNA a fini clinici era quindi inizialmente limitato.
Questi ostacoli non hanno scoraggiato la biochimica ungherese Katalin Karikó, che si dedicava allo sviluppo di metodi per l’utilizzo dell’mRNA a fini terapeutici. All’inizio degli anni ’90, nominata professore assistente presso l’Università della Pennsylvania, è rimasta fedele alla sua visione di realizzare l’mRNA come terapia, nonostante le difficoltà a convincere i finanziatori della ricerca dell’importanza del suo progetto. Un suo nuovo collega all’università era l’immunologo Drew Weissman. Egli era interessato alle cellule dendritiche, che hanno funzioni importanti nella sorveglianza immunitaria e nell’attivazione delle risposte immunitarie indotte dai vaccini. Spronati da nuove idee, tra i due è iniziata presto una proficua collaborazione, che si è concentrata sul modo in cui i diversi tipi di RNA interagiscono con il sistema immunitario.
La scoperta
Karikó e Weissman hanno notato che le cellule dendritiche riconoscono l’mRNA trascritto in vitro come una sostanza estranea, il che porta alla loro attivazione e al rilascio di molecole di segnalazione infiammatoria. Si sono chiesti perché l’mRNA trascritto in vitro venisse riconosciuto come estraneo, mentre l’mRNA proveniente da cellule di mammifero non suscitava la stessa reazione. Karikó e Weissman si sono resi conto che alcune proprietà critiche devono distinguere i diversi tipi di mRNA.
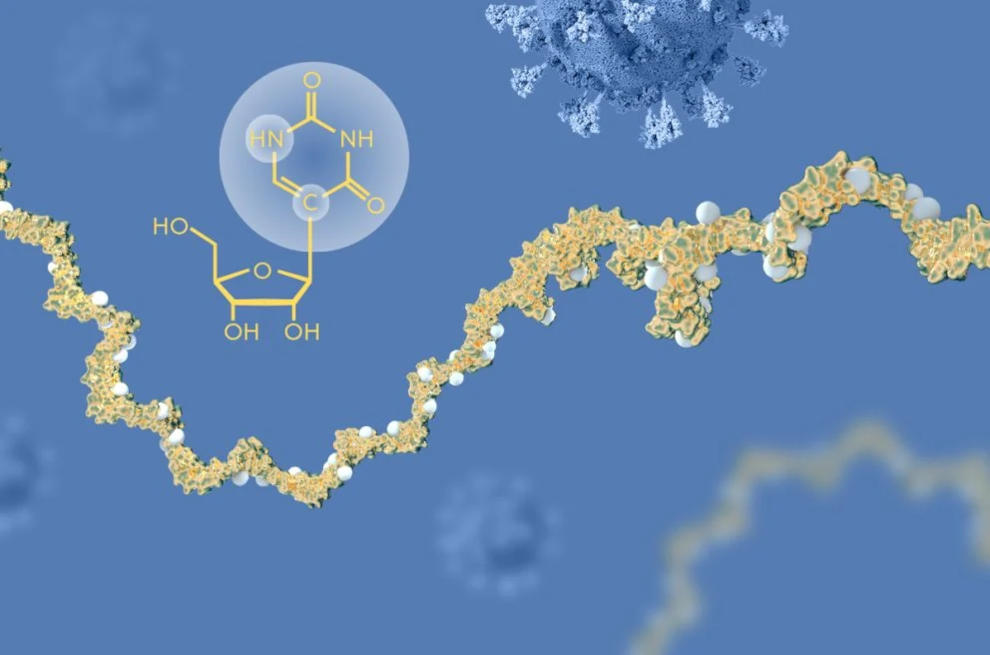
L’RNA contiene quattro basi, abbreviate in A, U, G e C, che corrispondono alle basi A, T, G e C nel DNA. Karikó e Weissman sapevano che le basi nucleosidiche nell’RNA delle cellule di mammifero sono spesso modificate chimicamente, mentre l’mRNA trascritto in vitro non lo è. Si sono chiesti se l’assenza di basi alterate nell’RNA trascritto in vitro
potesse spiegare la reazione infiammatoria indesiderata. Per indagare su questo aspetto hanno prodotto diverse varianti di mRNA, ciascuna con alterazioni chimiche uniche nelle loro basi, che sono state consegnate alle cellule dendritiche. I risultati sono stati sorprendenti: La risposta infiammatoria era quasi abolita quando le modifiche delle basi erano incluse nell’mRNA. Questo è stato un cambiamento di paradigma nella nostra comprensione di come le cellule riconoscono e rispondono a diverse forme di mRNA. Karikó e Weissman capirono immediatamente che la loro scoperta aveva un un profondo significato per l’utilizzo dell’mRNA come terapia. Questi risultati fondamentali sono stati pubblicati nel 2005, quindici anni prima della pandemia COVID-19.
In ulteriori studi pubblicati nel 2008 e nel 2010, Karikó e Weissman hanno dimostrato che la consegna di mRNA generato con modifiche delle basi di mRNA ha aumentato notevolmente la produzione di proteine rispetto all’mRNA non modificato. L’effetto era dovuto alla ridotta attivazione di un enzima che regola la produzione di proteine Grazie alla scoperta che le modifiche delle basi riducono le risposte infiammatorie e aumentano la produzione di proteine, Karikó e Weissman avevano eliminato gli ostacoli critici sulla strada delle applicazioni cliniche dell’mRNA.
I vaccini a mRNA hanno realizzato il loro potenziale
L’interesse per la tecnologia dell’mRNA ha cominciato a crescere e nel 2010 e diverse aziende stavano lavorando allo sviluppo di questo metodo. Sono stati realizzati vaccini contro il virus Zika e il MERS-CoV, quest’ultimo strettamente correlato al SARS-CoV-2. Dopo lo scoppio della pandemia COVID-19 due vaccini a base di mRNA modificati con nucleosidi che codificano la proteina di superficie del SARS-CoV-2 sono stati sviluppati a velocità record. Sono stati riportati effetti protettivi di circa il 95% ed entrambi i vaccini sono stati approvati già nel dicembre 2020. L’impressionante flessibilità e la velocità con cui possono essere sviluppati i vaccini a mRNA aprono la strada all’utilizzo della nuova piattaforma anche per i vaccini contro altre malattie infettive. In futuro la tecnologia potrà essere utilizzata anche per veicolare proteine terapeutiche e trattare alcuni tipi di cancro.
